中研院「研之有物」
COVID-19 至今仍深深影響全人類,新冠病毒持續演化,例如曾經造成臺灣大規模社區感染的 Alpha 變異株、傳染力更強的 Delta 變異株,近期出現的 Omicron 變異株等,它們逃避免疫系統的能力都不一樣,關鍵就在不同的棘蛋白(spike protein)結構。「研之有物」專訪中央研究院生物化學研究所徐尚德副研究員,他的團隊陸續解析各種新冠病毒變異株的棘蛋白結構,不但能釐清新的突變帶來的威脅,後續也可作為研發人造抗體的指引。
COVID-19 的病原體是一種冠狀病毒,和 SARS 病毒是近親,正式命名為 SARS-CoV-2,中文常稱作新型冠狀病毒。為了知道病毒如何感染人體細胞,以及如何逃避免疫系統的辨識,我們需要進一步瞭解冠狀病毒表面的棘蛋白結構。
結構為什麼重要?因為結構會影響蛋白質功能。蛋白質是由不同的氨基酸所組成的長鍊,實際作用時會摺疊形成特別立體結構,而冠狀病毒的蛋白質中,又以棘蛋白最為關鍵。
徐尚德強調,棘蛋白是冠狀病毒暴露在表面的蛋白質之一,絕大多數被感染者的免疫系統所產生的抗體都是辨識棘蛋白。因此現今臨床使用的蛋白質次單元疫苗、腺病毒疫苗以及 mRNA 疫苗,都是以棘蛋白為基礎來研發。
工欲善其事,必先利其器。解析蛋白質結構的方法很多,早期的 X 光晶體繞射(X-ray diffraction),就像將影片定格截圖,但不一定為蛋白質實際作用的狀態。
再來是核磁共振(Nuclear Magnetic Resonanc,簡稱 NMR),這是徐尚德留學深造時的專業,可以重現蛋白質在水溶液中的結構及動態,更接近實際作用的形態,可惜不適合分子量較大的分子。
目前結構生物學最具潛力的新技術是:冷凍電子顯微鏡(Cryogenic Electron Microscopy,簡稱 Cryo-EM),Cryo-EM 可以拍出原子尺度下高解析度的三維結構,此技術於 2017 年獲得諾貝爾化學獎。中研院則於 2018 年開始添購 Cryo-EM 設備,而 Cryo-EM 正是徐尚德用來解析棘蛋白結構的主要利器!
在 COVID-19 疫情爆發初期(2020 年 1 月),徐尚德就率先啟動新冠病毒的結構分析,當時他的研究團隊剛好已分析過感染貓科動物的冠狀病毒,對於解析棘蛋白結構有一定經驗,可說是贏得先機。
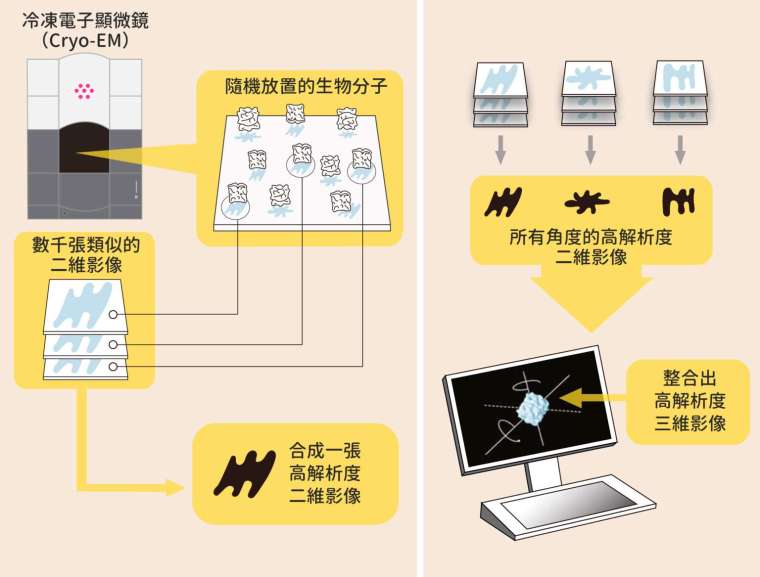
具體來說,如何用 Cryo-EM 解析新冠病毒的棘蛋白結構?
首先要大量培養新冠病毒、再分離、純化得到棘蛋白。接下來,將大量蛋白質樣本鋪成薄薄一層液體,之後以 -190℃ 急速冷凍,讓蛋白質分子保持凍結前的形態,最後用程式重建棘蛋白的三維影像。徐尚德譬喻,就像一匹馬在高速移動時,連續拍攝許多照片,再將照片疊加起來,重建馬的形狀。
棘蛋白的體積已經算大,假如又與其他蛋白質結合,體積將會更大。能解析如此龐大結構為 Cryo-EM 一大優點,但是也會創造很大的資料量。徐尚德強調,用 Cryo-EM 分析蛋白質結構不只做實驗,也要協調資料處理等疑難雜症。
儘管已有貓冠狀病毒的經驗,徐尚德研究團隊初期仍經歷一陣摸索,一大困難在於,做實驗時發現不少棘蛋白壞掉,不再保持原本的結構。
這是因為一般取得蛋白質樣本後會置於 4°C 冷藏,但 4°C 其實不適合保存棘蛋白。接著徐尚德細心觀察到,具備 D614G 突變的棘蛋白,保存期限竟然比沒突變的棘蛋白要長,可以從 1 天增加到至少 1 週。
什麼是 D614G 突變呢?武漢爆發 COVID-19 疫情的初版新冠病毒,其棘蛋白全長超過 1200 個氨基酸,D614G 突變的意思就是:第 614 號氨基酸由天門冬胺酸(aspartic acid,縮寫為 D)變成甘胺酸(glycine,縮寫為 G)。
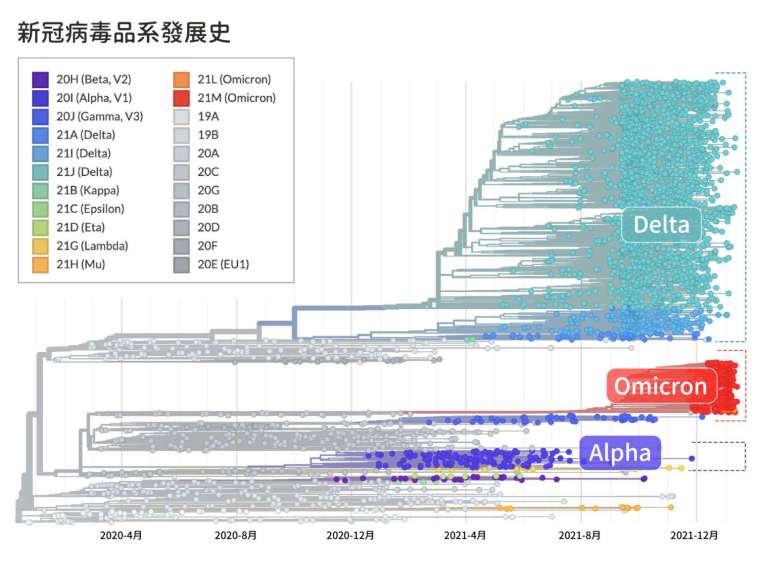
D614G 突變誕生後,存在感持續上升,2020 年 6 月時已經成為全世界的主流,隨後新冠病毒 Alpha、Delta 等變異株,皆建立於 D614G 的基礎上。
儘管序列僅有微小差異,許多證據指出 D614G 突變會增加新冠病毒的傳染力。有趣的是,它也能大幅增加棘蛋白在體外的穩定性。因此在研究用途上,變種病毒的棘蛋白反而容易保存,徐尚德更指出,對抗變種病毒的蛋白質次單元疫苗(subunit vaccine)穩定性也會增加。

徐尚德參與的一系列新冠病毒結構研究,除了棘蛋白本身,還包含棘蛋白與細胞受器 ACE2 的結合、棘蛋白和人造抗體的結合。
既然要解析結構,儀器「解析度」能看清楚多小的尺度就很重要!蛋白質結構學的常見單位是 Å(10-10 公尺),原子與原子間的距離約為 2 Å,Cryo-EM 的極限將近 1 Å,不過棘蛋白大約到 3 Å 便足以重建立體結構。
冠狀病毒如何感染宿主細胞,和結構又有什麼關係?棘蛋白位於冠狀病毒的表面,直接接觸宿主細胞受器 ACE2 的部分,稱為受器結合區域(receptor binding domain,簡稱 RBD),結構可能展現「向上」(RBD-up)或是「向下」(RBD-down)的狀態。向下,RBD 便不會接觸宿主細胞的受器,缺乏感染能力,;向上,RBD 方能結合受器,引發後續入侵。
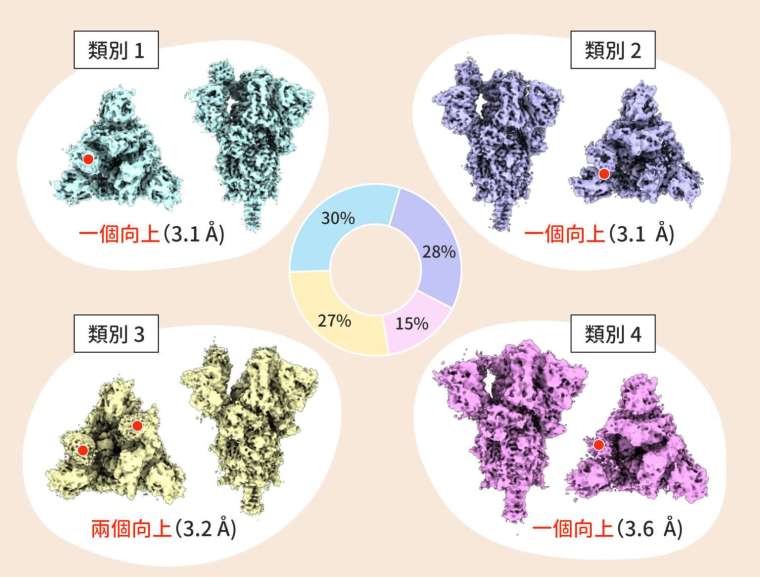
新冠病毒表面的棘蛋白有「三隻爪子」(3 RBD),RBD 有可能同時向上(3 RBD-up),也可能只有 1~2 個向上,結構會影響病毒的感染能力。更詳細地說,棘蛋白某些氨基酸位置的差異,會影響結構的開放與封閉程度。
棘蛋白向上或向下是動態的,假如能保持穩定性,延長向上的時間,也有助於新冠病毒的感染。這正是徐尚德一系列研究下來,實際觀察到不同品系的變化。
和武漢最初的新冠病毒相比,D614G 突變帶來什麼改變呢?簡單說:棘蛋白向上的比例增加了,導致整個結構變得更加開放,增加新冠病毒對宿主受器的親合力(affinity)。
以 D614G 為基礎,接下來又獨立衍生出數款品系,皆具備多個突變,傳染力、抵抗力更強 。影響最大的是首先於英國現身的 Alpha(B.1.1.7)、南非的 Beta(B.1.351)、巴西的 Gamma(P.1),以及更晚幾個月後,於印度誕生的 Kappa(B.167.1)與 Delta(B.167.2)。Alpha 一度於世界廣傳,導致包括臺灣在內的嚴重疫情,不過隨後不敵優勢更大的 Delta。
對於上述品系,徐尚德率隊一網打盡。 Alpha 的棘蛋白結構解析已經發表於 《自然-結構與分子生物學》(Nature Structural & Molecular Biology)期刊,其餘新冠病毒變異株的論文仍在等待審查,目前能在預印網站 bioRxiv 看到,該研究一次報告 38 個 Cryo-EM 結構,刷新紀錄。
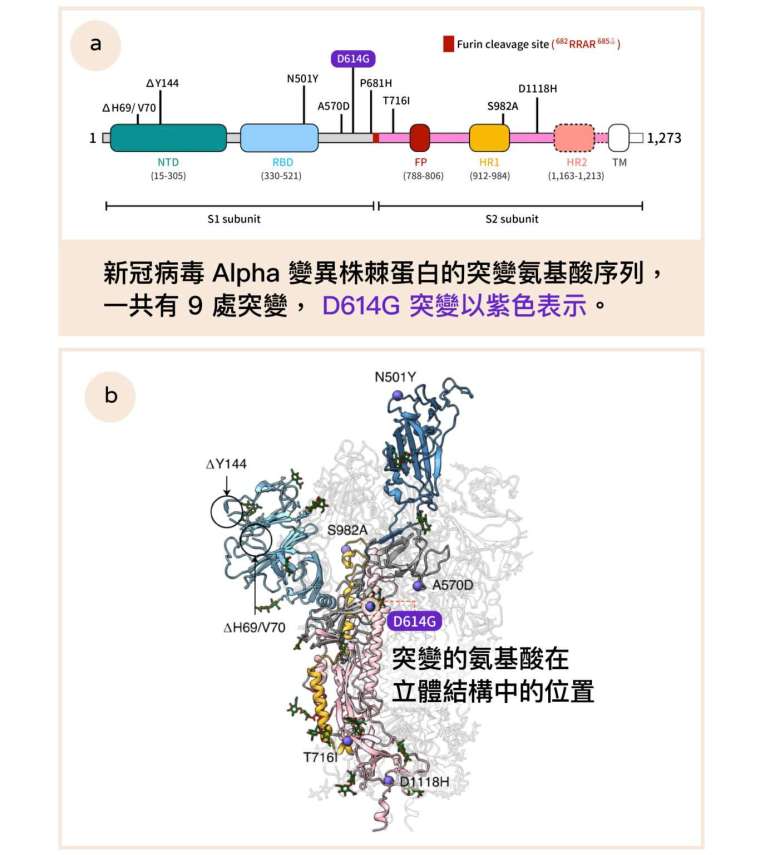
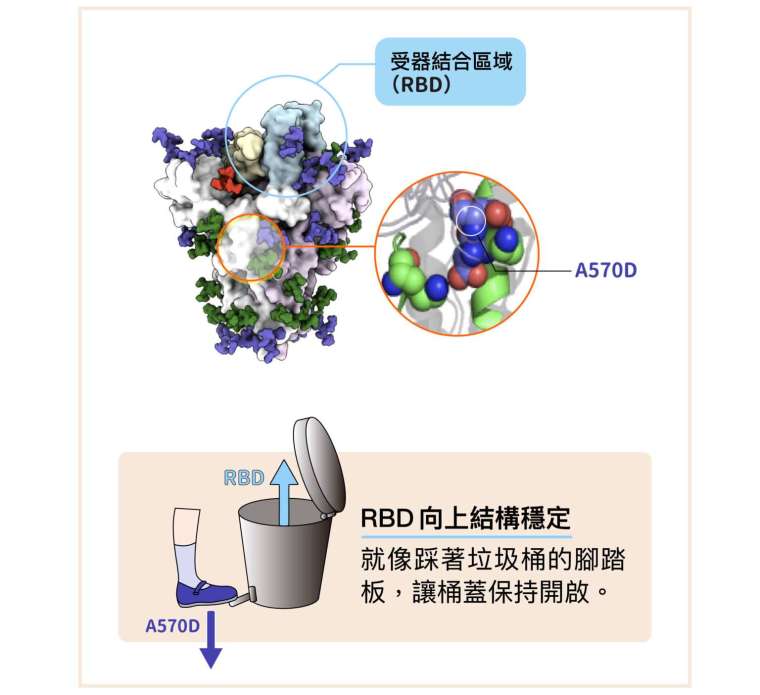
一度入侵台灣造成社區大規模感染的 Alpha 株有何優勢?其棘蛋白除了 D614G,還多出 8 處氨基酸突變,徐尚德發現 N501Y(天門冬酰胺變成酪氨酸)、A570D(丙胺酸變成天門冬胺酸)的影響相當關鍵。
直覺地想,棘蛋白的外層結構才會與受器接觸影響傳染力,立體結構中第 570 號氨基酸的位置比較裡面,乍看並不要緊。但是徐尚德敏銳地捕捉到,A570D 突變會改變局部的空間關係,令「RBD 向上」的結構更加穩定。徐尚德形容為「腳踏板」(pedal-bin)── A570D 突變的效果就像踩著垃圾桶的腳踏板,讓桶蓋(也就是 RBD)穩定保持開啟。
事實上,棘蛋白總體向上的比例,Alpha 還比單純的 D614G 突變株更少,不過 A570D 增進的穩定性似乎優勢更大。研究團隊製作缺乏 A570D 突變的人造模擬病毒,嘗試體外感染人類細胞,發現感染力明顯減少,證實 A570D 突變頗有貢獻。
另一個重要突變是 N501Y,不只 Alpha 有,Beta 等許多品系也有,Delta 則無。N501Y 在眾多品系獨立誕生,似乎為趨同演化所致。N501Y 能為病毒帶來哪些優勢?
第 501 號氨基酸位於棘蛋白表面,會直接與宿主受器 ACE2 結合。此一位置變成酪氨酸(tyrosine,縮寫為 Y)後,和受器的 Y41 兩個酪氨酸之間,容易形成苯環和苯環的「π–π stacking」鍵結,從而大幅提升棘蛋白對細胞的親合力。
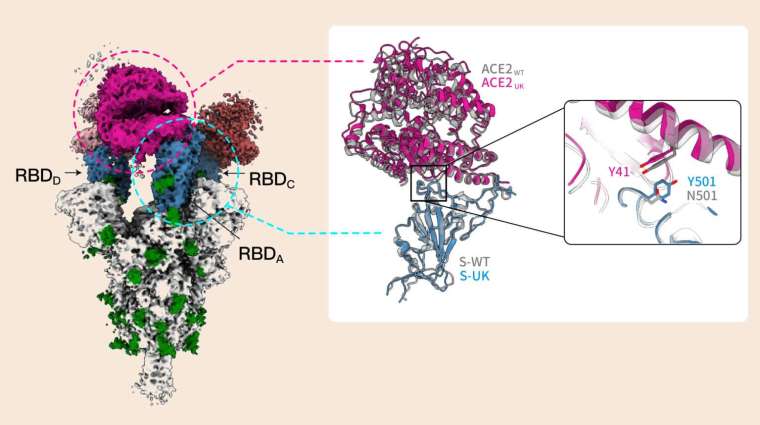
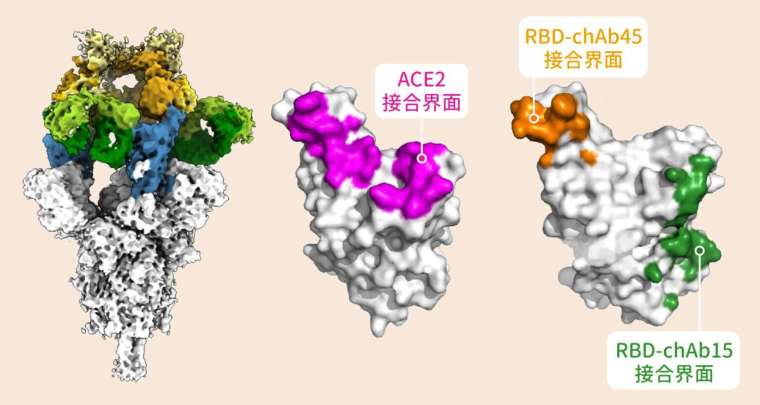
另一方面,N501Y 突變也會干擾抗體的作用。中研院細胞與個體生物學研究所的吳漢忠特聘研究員,率隊研發一批針對棘蛋白的人造抗體,測試發現有一款抗體 chAb25 對 D614G 突變株相當有效,但是對 Alpha 株無能為力。徐尚德由結構分析發現:N501Y 改變了棘蛋白表面的形狀,讓抗體 chAb25 無法附著。
好消息是,另外有兩款抗體 chAb15、chAb45,依然能有效對抗 Alpha 病毒,不受 N501Y 影響。這兩款抗體會附著在棘蛋白 RBD 的邊緣,避免棘蛋白和宿主細胞接觸。而且抗體 chAb15、chAb45 會各占一方,可以同時使用,多面協同打擊病毒。
有了 Alpha 的經驗,接下來分析 Beta、Gamma、Kappa、Delta 便順手很多。這批新冠病毒的棘蛋白變化多端,但是「RBD 向上」的整體比例皆超過 Alpha 和 D614G 突變株,可見適應上各有巧妙。徐尚德也發現,要釐清棘蛋白的結構,不能只關心蛋白質,還要考慮棘蛋白表面的醣基化(glycosylation)修飾。
蛋白質在完工後,某些氨基酸還能加上各種醣基。病毒蛋白質表面的醣基可以作為防護罩,干擾抗體和免疫系統的辨識。醣基化修飾就像替病毒訂作一套迷彩外衣,不同變異株的情況都不一樣,假如醣基化的位置和數量,由於突變而改變,便有可能影響立體結構,有助於它們閃躲抗體。例如和武漢原版新冠病毒相比,Delta 株棘蛋白少了一個醣化修飾,Gamma 株棘蛋白則多了兩處醣化。
還好從結構看來,並沒有任何突變組合能完美逃避抗體。例如由美國的雷傑納榮製藥公司(Regeneron)製作並通過緊急使用授權的抗體;以及中研院吳漢忠率隊研發,有望投入實用的多款人造抗體,對變異品系依然有效。這場人類與病毒的長期抗戰中,同時使用多款抗體的「雞尾酒」療法,仍然是可行的醫療方案。
回顧將近兩年來的研究之路,徐尚德表示:時間壓力真的非常大!COVID-19 疫情爆發後,全世界投入相關研究的專家眾多,只要稍有遲疑,便會落在競爭者後頭。但是即使跑在最前端的研究者,也只能苦苦追趕病毒演化的速度,一篇論文還在審查時,現實世界的疫情已經邁向全新局面。
人類要贏得勝利,必需全方面認識病毒,而結構無疑是相當重要的一環。
原文連結:
延伸閱讀:
上一篇
下一篇
