〈研之有物〉破解遺傳疾病、評估大眾用藥風險──全基因組分析
研之有物
「全基因組分析」有什麼用

每個人的身體狀況會因為居住環境、生活習慣而有相當大的差異。但對於同一家族裡的成員來說,相似的基因存在親戚手足之間,彼此未來健康與否,可以從家族病史中看出一些端倪。不過,或許在不久的將來,就可以透過個人的基因資訊,直接評估患病風險,還能篩選適合自己的用藥。

請問家族病史?
身體不舒服去看醫生時,會填一張病歷表,其中一項常見的問題是:家族有哪些病史。
疾病的成因,有些是因為先天基因變異,有些是後天環境、飲食、傳染病造成。
詢問家族病史的目的在於,相似的基因自祖父母、雙親,再傳到子代,想知道罕見遺傳疾病、甚或癌症、心血管疾病、糖尿病等發生的機會,過往是透過詢問「家族病史」來瞭解。但未來將有更精確的方式預估患病風險——直接查看基因資訊。
罕見遺傳疾病:分析單一基因變異
針對單一基因異常造成的罕見遺傳疾病,郭沛恩團隊使用「全基因組遺傳分析」(full genome analysis) 來分析病因。
這類罕見遺傳疾病,包含先天性異常 (congenital anomalies) 、神經退化性疾病 (neurodegenerative disease) 等等。全基因組遺傳分析分成兩個部分,只要從血液、口水取得可供分析的 DNA,就可以進行全基因體定序 (whole genome sequencing),了解該 DNA 片段的鹼基如何排列;以及繪製全基因體圖譜 (whole genome mapping),了解該 DNA 片段在染色體上的位置。

首先,「全基因體定序」,是將已發病患者的 23 對染色體中,每一個基因全部都定序。定序完成後,參考已知的生物學、基因組學、醫學等知識,確認影響發病的基因;或是藉由比對健康雙親的基因,從可能的序列中搜尋基因變異處,再找出罕見遺傳疾病的發病機制。
接著,再利用「全基因體圖譜繪製」,來組裝長片段的 DNA,以提高基因排列的正確性、以及偵測結構性變異的靈敏度。
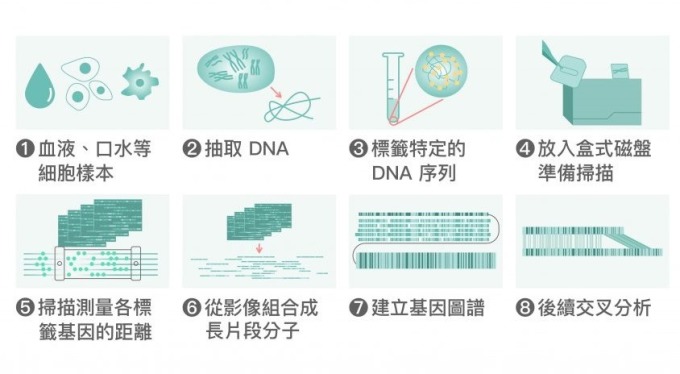
如上圖所示,郭沛恩團隊建立基因圖譜 (gene map) 的方法,是先將 DNA 分成較大的片段,利用特定的酵素來標記 DNA 上的特定序列,並黏上螢光當作標籤 (label)。透過機器測量各個螢光標籤之間的距離後,再從影像組合成長 DNA 片段,並定位出該 DNA 片段在染色體的位置。
全基因體圖譜繪製,彌補了全基因體定序讀取長度限制的缺憾;而全基因體定序,則提供了準確的 DNA 序列。
藉由這兩個方式,團隊得以進行全基因組遺傳分析 (full genome analysis) ,進而探討罕見遺傳疾病的致病因子。
「DNA 裡充滿重複的序列,讓重建工程增添難度。但如果找到特殊的序列,對定序會很有幫助。」郭沛恩提到。相較於小片段 DNA,團隊所使用的較大 DNA 片段有更多序列線索,可以辨認、拼湊出基因原本排列的順序。將辨認大片段 DNA 得到的基因圖譜拼在一起,就能重組整條染色體。
大眾常見疾病:分析多基因關聯
對於「單一」基因異常造成的罕見遺傳疾病,能藉由全基因組定序 (whole Genome Sequencing) 和全基因組圖譜繪製 (whole genome mapping) ,找到可能致病的遺傳因子,再進一步研究發病原因與機制。
但面對「多基因」交互影響的疾病,例如糖尿病、癌症、心血管疾病、精神疾病等等,上述的全基因組遺傳分析 (full genome analysis) 就無法測出各個單一基因對疾病的影響程度。因為,以心血管疾病來說,少部分為單基因遺傳疾病,而大部分為多基因加上環境飲食等因子交互影響所致,病因相當複雜。
針對多基因影響的常見疾病,郭沛恩研究團隊利用另一種方法:全基因組關聯分析 (genome-wide association study,簡稱 GWAS)。
全基因組關聯分析 (GWAS) 搭配醫療資料的大數據分析,期望能找到與疾病預防、進程、及治療相關的生物標記 (biomarker),也就是體內可以反應某種疾病狀態的指標。目前,郭沛恩團隊正積極地與臺灣各大醫院合作,運用此方法,推行和大眾健康息息相關的「臺灣精準醫療計畫」。
在臺灣精準醫療計畫中,郭沛恩團隊透過文獻收集與疾病相關的「已知」基因變異點,並設計適合檢測該基因位點的晶片,之後病人的檢體就會利用這張晶片進行全基因組關聯分析 (GWAS),確認病人的基因是否在該處有變異情況。
另一方面,由於多數疾病的基因變異點尚「未知」,團隊可藉由全基因組關聯分析 (GWAS) 探究大量的病患基因樣本,從大數據找出與該疾病相關的致病基因;換句話說,當某種疾病的大多數病患,幾乎都在某處基因出現問題,就能推測其為關鍵的基因變異位點。
若想了解個人罹患糖尿病、癌症、心血管疾病等等這類常見疾病的風險,大眾可先進行基因檢測,建立自己的基因遺傳輪廓 (gene profile),並透過上述的全基因組關聯分析 (GWAS) 觀察基因變異點或表現量,再與自己的臨床病歷比對分析,就可從基因評估患病風險,比參考家族病史更為準確。
降低藥害風險:體外基因檢測
另外,由於不同的基因型會影響人體對藥物的反應,經由體外的基因檢測 (gene test),也能事先得知病患對藥物的反應,協助醫生選用最適合的藥物。
基因檢測除了讓醫療決策更精準,用藥也能更符合個人需求。
目前市面流通的藥物,多數是由歐美國家針對西方人開發,用在亞洲人身上可能沒有效果、甚至有害。例如,治療心血管疾病常用的抗凝血劑 Warfarin (音譯華法林)。
Warfarin 是從老鼠藥研發而來,具有相當程度的毒性,運用於人體醫療可以預防中風、心臟病。但因為亞洲人缺乏代謝此藥物的基因,很容易產生副作用,用藥過量會出血死亡。2006 年,中研院陳垣崇院士已經找到 Warfarin 的基因標的,並與醫院合作進行用藥前的基因篩檢。
至於常用於治療癲癇與三叉神經痛的藥物 Carbamazepine (卡巴氮平),誤用會引起史蒂文生氏強生症候群 (SJS), 與毒性表皮溶解症 (TEN) 等皮膚病徵。在用藥前先進行基因檢測,可以避免病人為副作用所困擾。
目前在臺灣部分大醫院進行單一位置的基因檢測,所費不貲。後續郭沛恩研究團隊若與健保合作,可以讓大眾用較低的費用了解自己的基因組資訊。
但為了達成精準醫療,除了檢測個人基因資訊,還需要蒐集臨床病歷資料、日常運動與飲食習慣等等。資訊越詳細,對疾病預測、治療越有幫助,但前提是要獲得個人的同意。郭沛恩想像,或許有一天,人人身上都有穿戴式裝置的追蹤器,就可以精確蒐集各種訊息。
「但個人意願如何,這就不知道了。」郭沛恩說。
需要時間證明成效
2018 年初,針對罕見遺傳疾病的全基因組遺傳分析 (full genome analysis) 計畫才剛開始,至少需要一年的時間來執行;至於目標是運用全基因組關聯分析 (genome-wide association study) 提升大眾健康的「臺灣精準醫療計畫」,郭沛恩則期望在這個計畫推行一年半的時候,評估與健保系統合作的可行性,以及是否能真的找到目前未知的致病基因。
與疾病篩檢的「目的性」檢驗不同,臺灣精準醫療計畫偏向「預防性」檢測。
計畫推廣的同時,需要更大量的樣本協助研究。但基因組分析通常會是在人們健康的時候進行,不同於以往大眾所熟悉的目的性疾病篩檢,推廣的過程勢必會受到質疑。面臨這個挑戰,郭沛恩表示研究團隊必須加強示範基因檢測的實際益處,而非以純粹提供數據讓科學家研究為理由來說服民眾。
可預先分析新生兒的基因嗎?
分析雙親的基因組資訊,的確可以預測新生兒可能面臨的遺傳疾病,但實際狀況依然要等胚胎成形後才能確認。若是從胚胎中取出細胞,並將細胞核中的基因組完全定序,避開疾病與缺陷,只留下優良的基因組合就不再只是夢想。
要完整分析基因組,需要約一百萬個細胞。但在胚胎時期,頂多只能取得幾個細胞,遠不及基因定序所需的量。但即使技術上可行,在倫理層面,郭沛恩還是覺得極不妥當。「我們不知道甚麼樣的寶寶是最好的。」郭沛恩認為,聰明的、健康的、外貌出色的,對每位父母而言「最好的寶寶」都不一樣。
況且,不符合這些特徵的新生兒,並不代表沒有活下來的權力。因此郭沛恩強調,用全基因組分析來篩選小孩,絕對不是個好主意。
臺灣得天獨厚的優勢
時任生醫所所長的劉扶東升任中研院副院長後,原本一年約莫來臺灣一次的郭沛恩收到擔任所長的邀請。但對於香港長大,在美國就讀大學,並一路當上加州大學舊金山分校皮膚科教授、心血管研究所特聘教授的郭沛恩來說,離開熟悉的環境需付出相當龐大的代價。「我其實沒有想過要離開舊金山,因為研究進行得很順利。」
不過,得知有機會能將精準醫療計畫付諸實行後,郭沛恩對來到臺灣工作相當期待。因為歐美國家也曾推行精準醫療,但歐洲國家如瑞典、荷蘭,將重點放在費用昂貴的全基因體定序。「一個人定序要一千美金,瑞典全國定序要花一百億,很難找到這麼多經費。」郭沛恩提到執行的困難時說。
至於美國,除了民族組成複雜增加分析難度,缺乏完善的健康福利政策更讓基因醫療窒礙難行。由於美國人民的健康保險,是由任職的公司向合作的私人保險集團投保,只要換工作就會由新的保險公司接手,因此當下發生意外或疾病才會給付醫療服務。加上私人保險集團以營利為宗旨,防患未然的基因檢測很難要求保險公司給付。
有些國家有健康照護問題,有些國家則是樣本數量不足。擁有全民健保、人口又夠多的臺灣,確實是個合適的地方。「再說,政府也很有興趣,因為這計畫有機會節省醫療支出,又讓大家更健康。」郭沛恩說。
在美國進行研究多年,後應邀來臺灣,熟悉兩方研究環境的郭沛恩指出,兩國在研究領域都有聰明的人才,差異在於行政系統。在美國,每一筆花費都必須各別申請,雖然申請很困難,但獲得的經費很多;至於臺灣,整筆研究經費是來自國家,雖然資源有其侷限,但研究員有較大的自主空間,可以探索感興趣的領域。
和能力相應的薪資與友善的環境,是招募人才不變的道理。
對於人才招募,郭沛恩認為:資源 (或薪資)、名譽、還有工作的快樂,是讓人有動力工作的要素。只要臺灣能提供與能力相對應的待遇,就能吸引各地優秀的人才一起來合作。問及現在工作的心得,郭沛恩笑著說:「這裡的同事彼此會熱心地提供協助,工作起來很愉快。」
延伸閱讀:
- 郭沛恩的個人網頁
- Mostovoy Y, Levy-Sakin M, Lam J, Lam ET, Hastie AR, Marks P, Lee J, Chu C, Lin C, Džakula Ž, Cao H, Schlebusch SA, Giorda K, Schnall-Levin M, Wall JD, Kwok PY.A hybrid approach for de novo human genome sequence assembly and phasing. Nature Methods. 2016 May 9.
- Lam ET, Hastie A, Lin C, Ehrlich D, Das SK, Austin MD, Deshpande P, Cao H, Nagarajan N, Xiao M, and Kwok PY. Genome mapping on nanochannel arrays for structural variation analysis and sequence assembly. Nat Biotechnol. 2012; 30:771-6.
- 美債、黃金、日元全倒 美元何以獨自挺立?
- 掌握全球財經資訊點我下載APP
文章標籤
- 講座
- 公告
上一篇
下一篇